原创 朝文道 朝文道 心血管前沿解读 2022-08-30 11:01 发表于江苏
收录于合集
#文献1个
#基因检测1个
#心肌病1个
#心血管1个
您现在阅读的是原创文献分享栏目「朝文道」第 3 期。我们每期介绍一篇心血管顶刊的最新文献,并深入探讨相关临床问题的现状和进展。请您审阅,多多批评指正!

心肌病和心律失常的基因检测——被忽视的手段
既往国内外大规模流行病学调查显示肥厚型心肌病(HCM)的患病率约为 1/500。随着对心肌病理解的深入以及心脏超声、心脏磁共振等检查水平的提高,学者们发现心肌病的患病率显然是被低估了的。近年来国外的研究报道 HCM 在人群中患病率估计达 1/200,扩张型心肌病(DCM) 为 1/250,致心律失常性心肌病(ACM)为 1/2000。据此估算我国 HCM 患病人数可达 700 万人,DCM 达 560 万,ACM 则为 70 万。这些疾病很多是单基因遗传病,即个体性状受一对等位基因控制,按照孟德尔遗传定律进行传递,遗传模式包括常染色体显性遗传、常染色体隐性遗传及性染色体连锁遗传等。并且部分心肌病有家族遗传聚集特点,因此,明确先证者的诊断并给予家庭成员级联筛查对于猝死的预防就显得尤为重要了。目前,基因诊断是临床和实验室早期识别单基因遗传病的最有效手段,2022 年 EHRA/HRS/APHRS/LAHRS 联合发布了《心脏疾病的基因检测现状专家共识》,指导临床该如何进行基因检测。本期分享的发表于 JAMA Cardiology 上的新研究也关注了心肌病和心律失常的基因检测问题,着重评价了联合两类疾病的基因检测组合对疑似遗传性心肌病或心律失常患者的诊断率和临床管理的意义。

下面我们详细来聊一聊。
研究详情
背景知识
基因检测之于遗传性心血管疾病的作用
基因检测在临床上的实际应用频率远远低于遗传性心脏疾病的患病率,原因往往与经济花费、数据检测解读的准确性以及检测的敏感性和特异性等问题对医患沟通产生的负面影响有关,尤其当患者处于疾病早期、症状并不十分明显时,要说服他们花大价钱做一个也许得不到确定结果的检查,着实不容易。
但是,找到这些遗传性心脏病的遗传变异是非常有价值的,这个价值不仅局限于患者本身的疾病诊断,还可以对家庭成员的潜在疾病进行预测性分析,指导治疗策略、协助生殖决策并提供预后信息,这些信息对一整个家庭、甚至几代人来说都有价值。
随着二代测序(NGS)技术的进步,基因检测的成本和速度有了大幅提高,并且允许开发基因组套(通常 50-100 个基因)以及全外显子组和全基因组测序(大约 22000 个基因)。这为心内科临床遗传性心脏疾病的诊治提供了一个更有力的检测手段。
而心肌病和心律失常可能有重叠的临床表现,同一基因的变异可能会产生超过 1 种表型,支持心律失常和心肌病相关的共有遗传因素的证据也在逐渐增加,这意味着包含心肌病和心律失常的基因组合检测可能会提高诊断率。一些证据发现扩展的基因组合检测并不能实质性增加 HCM 检测的敏感性,并有可能会增加不确定变异的检出率。因此,需要进一步探索以权衡诊断率和不确定结果的影响。
基因检测的变异分类以及解读
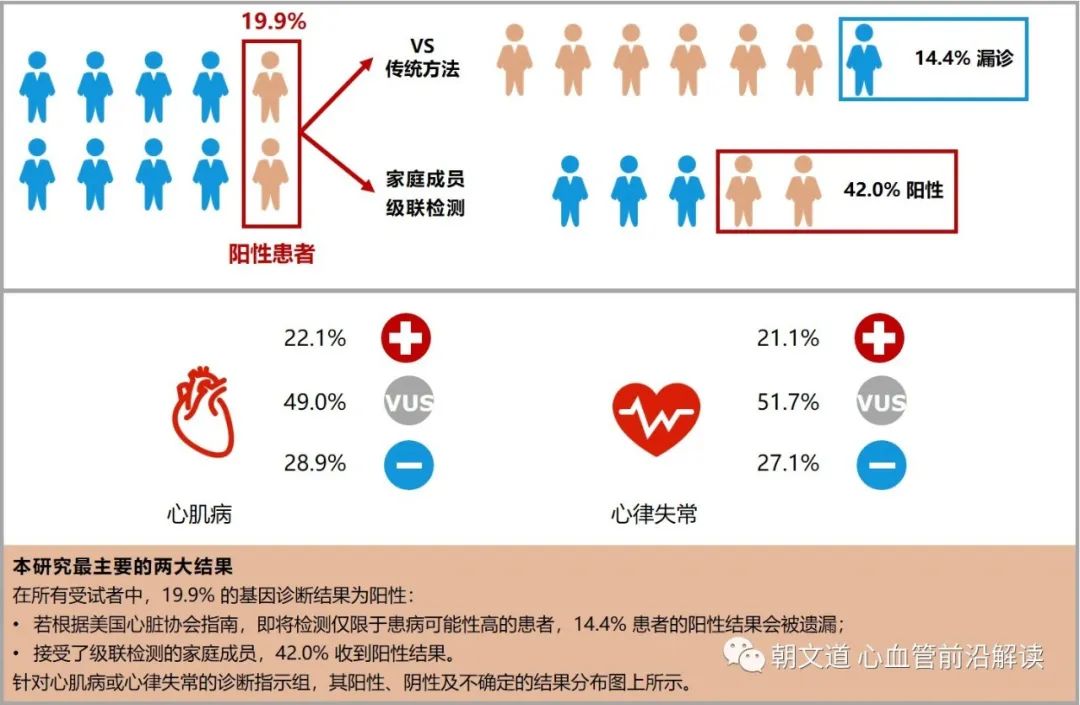
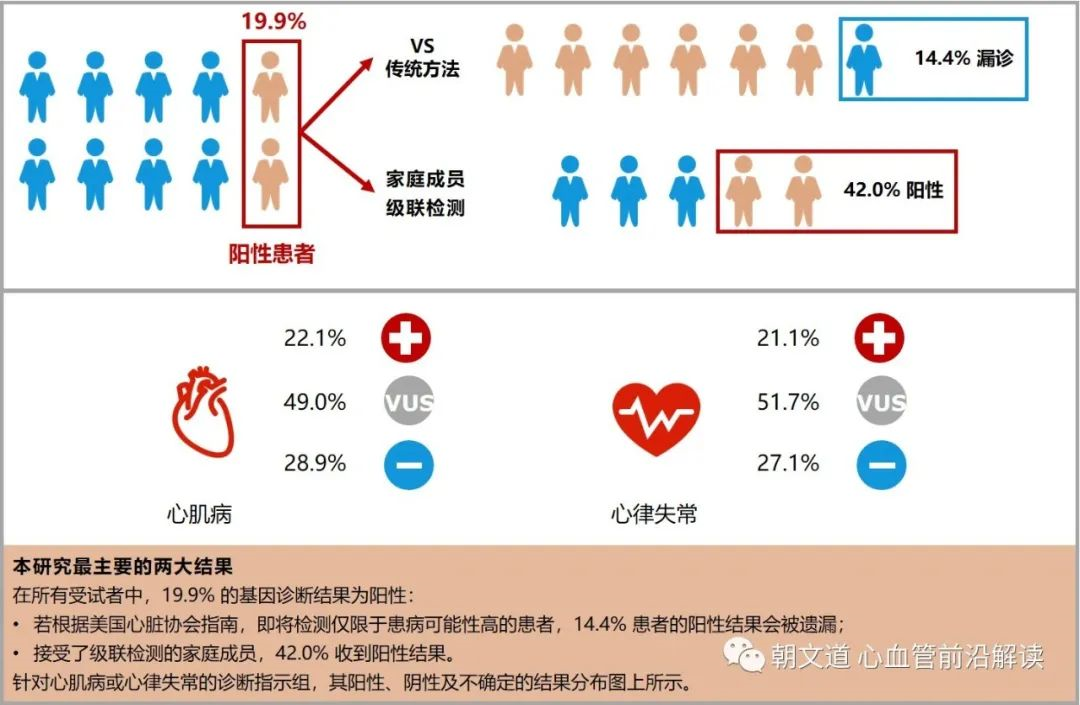
一个样本经过 NGS 检测后会呈现大量的变异数据,如何从海量的数据中找到跟疾病发生发展和用药相关的基因突变呢?一般由实验室产生原始数据传给生信部门,生信分析系统通过设置一系列筛选条件把范围缩小到一定范围。最终剩下的这些变异需要我们做人工判断。2019 年 ACMG 发布了最新的遗传变异分类标准与指南,该指南建议使用特定标准术语来描述孟德尔疾病相关的基因变异——“致病的(P)”、“可能致病的(LP)”、“意义不明确的(VUS)”、“可能良性的(LB)”和“良性的(B)”。根据所识别变异的分类和相关疾病的遗传模式,基因检测结果被分类为阳性(Positive)、阴性(Negative)、携带者(Carrier)、不确定(Uncertain)。
研究设计
在 2019-07-12 至2020-07-09 的一年时间内,这项队列研究通过临床医生依据患者的临床特征推荐这些患者接受免费的商业基因检测。检测的样本来自患者的血液、唾液,部分采用患者尸检样本的 DNA。
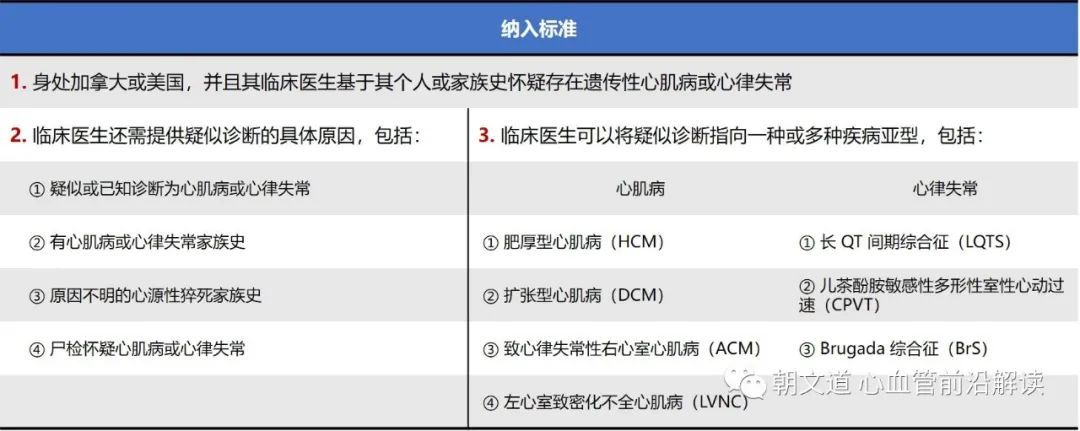
临床医生需对每位患者的疑诊做出个人评估,用低、中、高度怀疑来表示自己的临床考量。检测机构使用 NGS 技术同时检测序列和外显子水平拷贝数变异,对多达 150 个与心肌病或心律失常相关的基因进行测序。初级组包括与心肌病和心律失常相关的 67 个基因。在检测前或收到初始结果后,患者均可选择拓展增加 4 个可选的附加组(包括与心肌病和心律失常初步相关的基因)。检测报告将变异分类为致病性或可能致病性(P/LP)、意义不确定以及可能良性或良性 3 大类,分类基于Sherloc 框架(一种符合 ACMG 和 GAMP 指南要求的基于点的证据评分系统), 25个结果根据所鉴定的变异类型和相关疾病的遗传模式被分为阳性、阴性、携带者或不确定。诊断阳性率定义为基因检测结果阳性的患者占所有临床医生已表明个人已知或疑似心肌病或心律失常的患者的百分比,并在分析中按初始的指征、疑诊指数、年龄和生命状态进行分层。并且在阳性患者中,对那些由临床医生指出特定心肌病或心律失常亚型的那些进行分析,评估限定指征的基因检测带来漏诊的可能性。在患者收到阳性结果后,对其家属进行级联筛查。
重要结果
12 个月的时间内,4782 名患者接受了基因检测,
- 其中 4270 人(89.3%)在检测前医生给出了疑似或已知遗传性心肌病或心律失常的个人诊断,这些人心肌病占 60.8%;
- 其余 512 例患者(10.7%)中,家族史和/或怀疑与心律疾病相关的死亡是临床医生提供的唯一怀疑原因。
家族史方面,49.3% 的患者有至少 1 类家族史,38.0% 的有原发性心肌病或心律失常家族史,23.7% 有不明原因心源性猝死家族史,597例患者(12.5%)有两者的家族史。疾病类型方面,临床医生给 41.9%的人打了多个疑诊原因,也就是说超过 2/5 的患者的情况比较复杂。78.7% 的指向心肌病或心律失常的患者有至少 1 种亚型,最常见的亚型是 HCM(41.5%)、DCM(28.7%)和长 QT 综合征 (BrS)(16.5%)。临床怀疑指数方面,至少 1 种亚型的患者中,其中 61.4% 例由临床医生给出的高度怀疑指数,34.2% 具有中度怀疑指数,4.4% 具有低度怀疑指数。
联合心肌病和心律失常的基因组合检测可提高患者及其亲属的诊断率
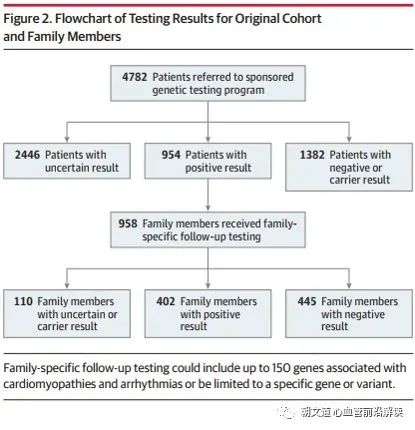
通过联合心肌病和心律失常的基因组合检测,研究在所有 4782 例患者中确定 954 例(19.9%)的基因诊断结果为阳性。怀疑指数高的患者比怀疑指数低的更有可能得到阳性结果(高 25.7% vs. 低 9.0%),但低怀疑指数的患者中仍有 11 名为阳性, 如果按 AHA 指南的建议并且将低-中等怀疑指数的患者排除在基因检测之外的话,至少有137例(14.4%)阳性患者将被遗漏。这一结果说明过分依赖临床表型的指向意义来做出基因检测的推荐的话有可能会导致相当比例的漏诊。在 954 例阳性结果患者中,不到 1/3 的患者(306例,32.1%)的亲属接受了随访基因检测,共 958 位家属接受检测, 其中 402 人(42.0%)出现了阳性结果,445 人(46.5%)得到阴性结果。如果先证者接受了疾病特异性基因检测,而非联合疾病基因组合检测的话,那么家系成员检测中有4.5% 的阳性病例 (大约 1/23)将被遗漏。这意味着阳性结果先证者的近亲属进行临床筛查(如果有一级亲属在世)尤为重要。此外,46.5% 的患者家属收到了阴性结果,可使得他们能够避免密集的纵向筛查。
不同临床指示组的诊断率不同
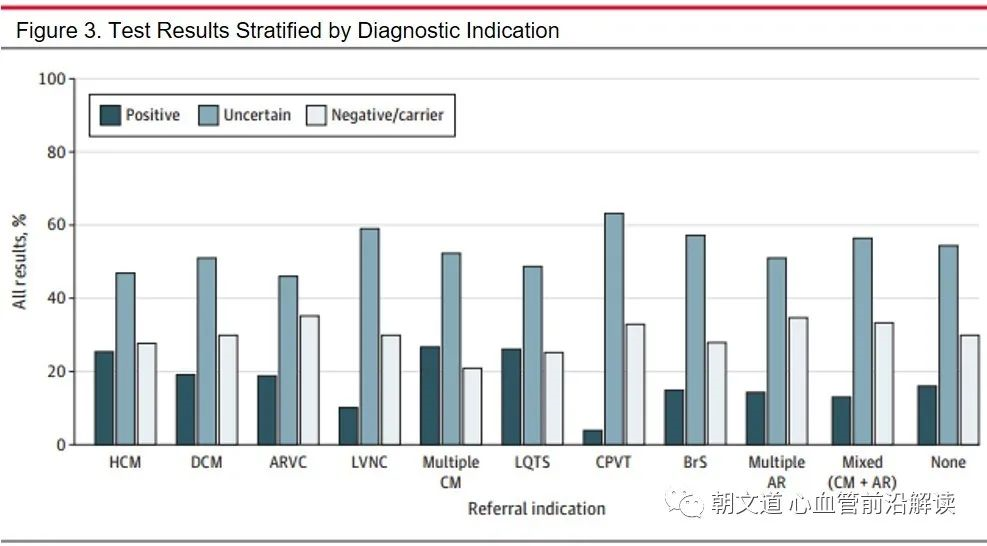
4270 例患者中有867例(20.3%)诊断为心肌病或心律失常,不同疾病组的诊断率不同。
- 在单一心肌病亚型的患者中,HCM 的阳性检出率最高(25.4%),左室致密化不全心肌病(LVNC)的阳性检出率最低(11.1%);
- 在心律失常特异性诊断指征中,LQTS 的阳性检出率最高(26.1%),儿茶酚胺敏感性多形性室性心动过速(CPVT)的阳性检出率最低(3.9%)。
- 对于具有多种心肌病亚型的患者,阳性检出率为 26.7%;对于有多种心律失常亚型指征的患者,阳性检出率为 14.3%。
- ACM 的 VUS 率最低(46.0%),CPVT 最高(63.2%)
阳性结果患者可能的预后或以及临床管理策略调整
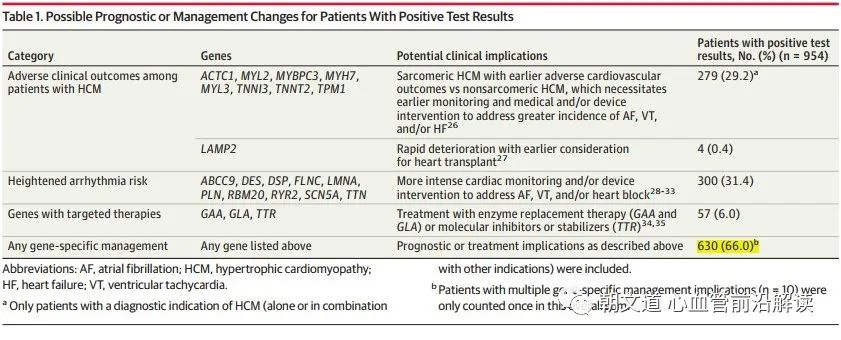
总体上,基于阳性基因检测结果,有 66.0% 的患者(954 名患者中的 630 名)可获得医师做出的个性化治疗策略,如安排更密集的监测随访、调整药物或器械的使用等。279 名患者(29.2%)检出到肌小节相关 HCM 的阳性结果,与肌小节无关的 HCM 相比,其不良结局更多。4 名患者(0.4%)检出 LAMP2 基因阳性结果,预示着这些患者更有可能面对疾病快速进展的情况。300 名患者 (31.4%) 的阳性结果与心律失常风险升高有关;有 57 名患者(6.0%)检出到可使用靶向分子治疗的基因变异。
综合基因检测提供的诊断增益
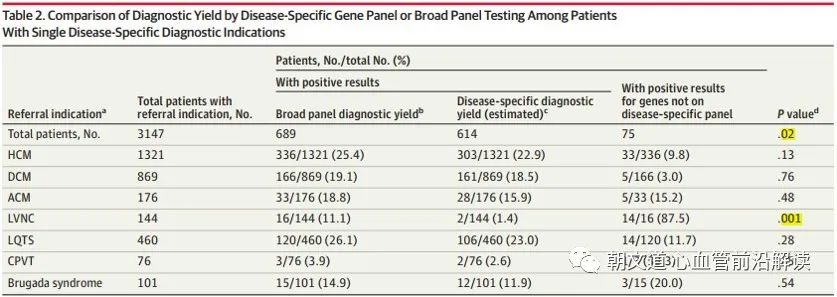
与商业实验室提供的单一疾病特异性检测相比,联合基因检测显著提高了 10.9% 的阳性检出率,(614 VS 689, P < 0.001)。这一优势在左室致密化不全心肌病上尤为明显,尤其考虑到该病没有明确定义并且几乎没有确定的基因,因此联合检测也许会对这类疾病的患者有而额外的帮助。
局限性
由于临床数据未通过医疗记录确认,且临床医生只需要记录患者参与该计划是符合资格的,因此,某些临床信息可能被忽略了。
- 针对家系成员的基因检测数据只能从本研究实验室获得;不排除在其它实验室接受级联检测的可能。因此,研究中执行的测试数量可能被低估了。
- 为了纳入更多的患者,该项目的检测是免费的,但如果将不同意接受有偿检测的患者纳入研究中可能会引入偏倚
大咖点评

提醒临床医师注意基因检测的重要作用
VUS trade-off
- 本研究也重点讨论了这一问题,即尽管检测更多基因以提高遗传诊断率是非常重要的,但是需要权衡的是 VUS 的检出率可能也会升高。
- 最后,作者指出了几条可能有助于解释 VUS 结果的方法,包括:
准确评估患者的表型
全面的检测前和检测后遗传咨询
评估变异致病性的专业知识
家庭成员的共隔离研究
联合功能基因组学平台(例如细胞模型)
利用新的机器学习变异算法
获取专业的多学科心血管遗传中心的支持
走进临床
我们充分了解了基因检测不仅对患者本人有意义,更对他背后的一整个家庭都有重要提示作用。回到文章开始提到的病例,如果时光倒流,或许我依然救不了这个年轻小伙的生命,但至少或许可以通过基因检测给心碎的母亲一个交代,也给她和她仅剩的女儿做一次基因检测,如果是阴性的,可以给他们一个安心,如果不幸是阳性的,也给她们提早预防的机会。
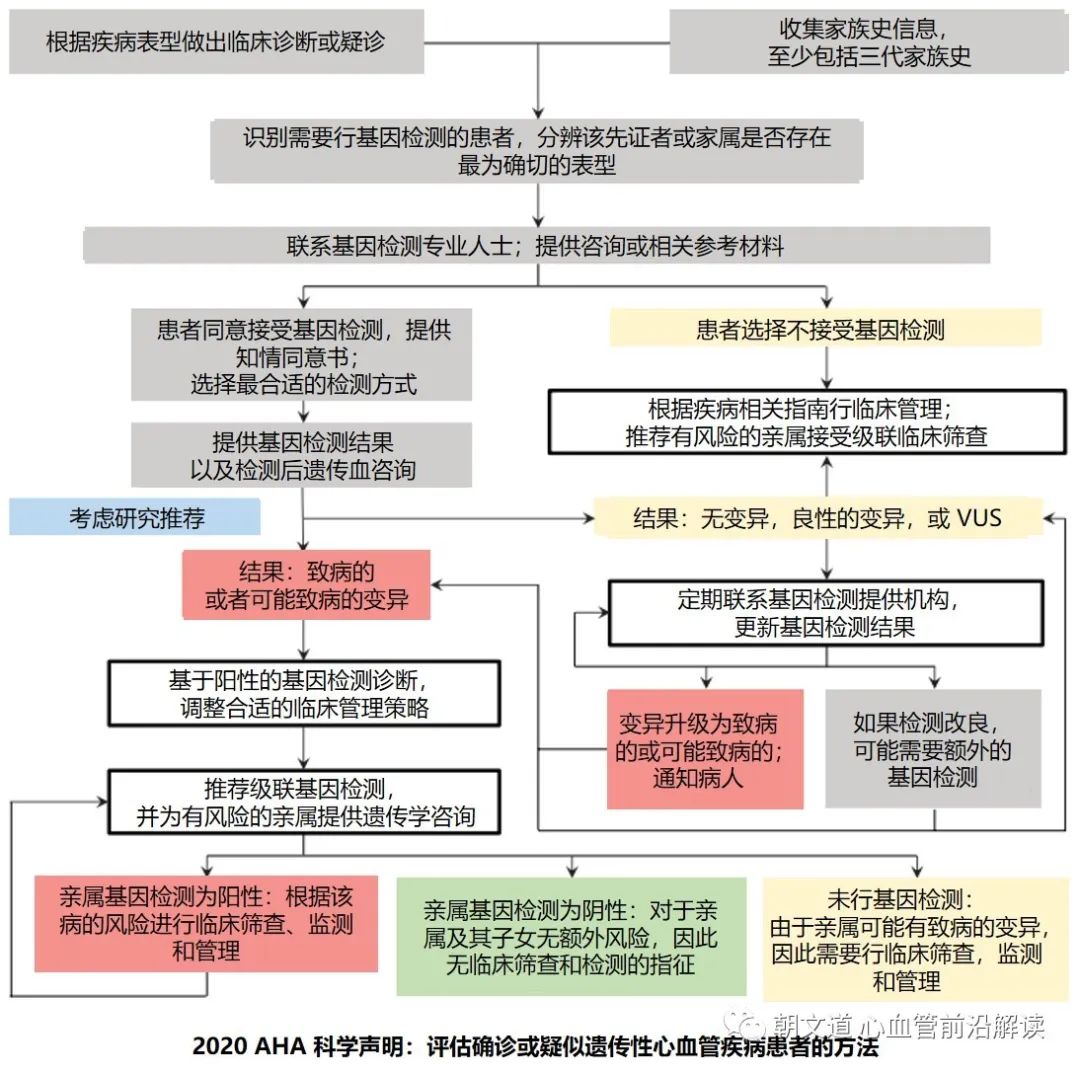
具体的筛查流程我们可以参考 2020 年 AHA 发布的科学声明《Genetic Testing for Inherited Cardiovascular Diseases》,并且结合本文的联合心肌病和心律失常的基因组合检测策略。
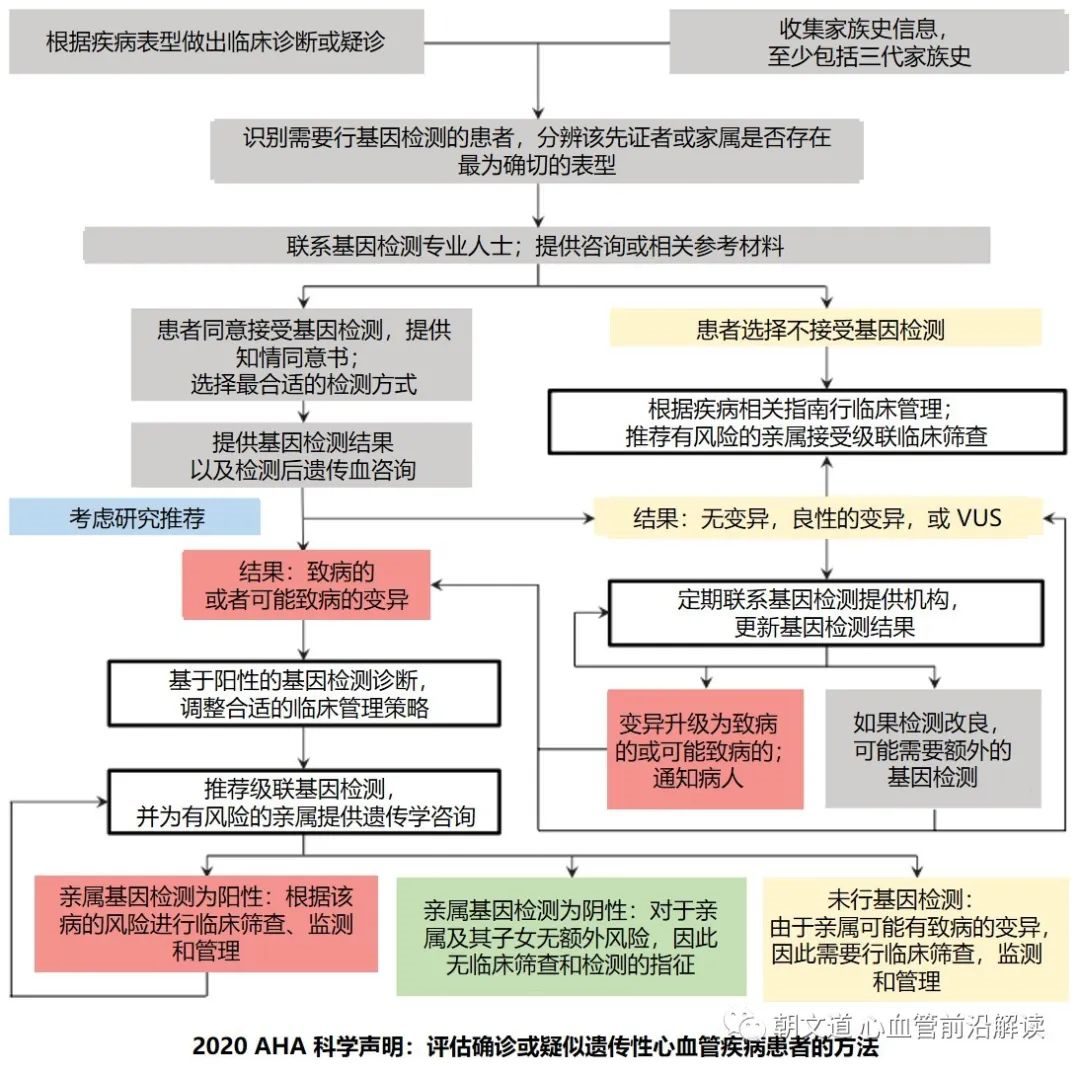
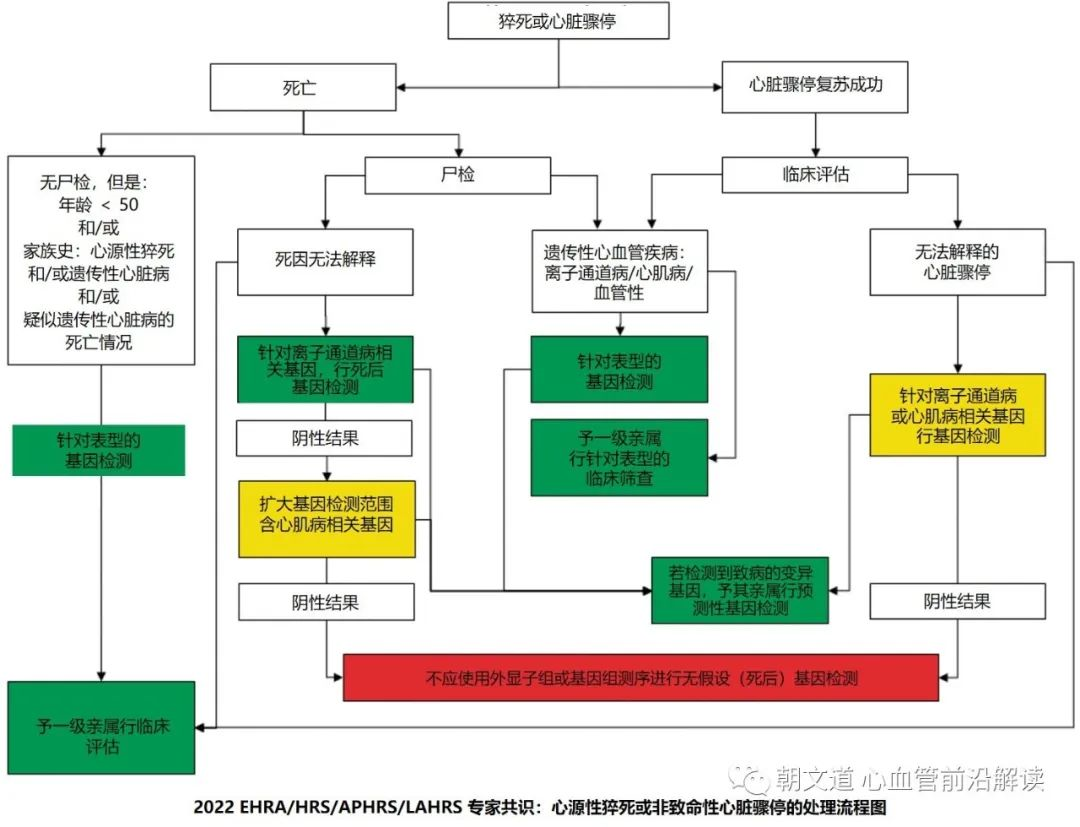
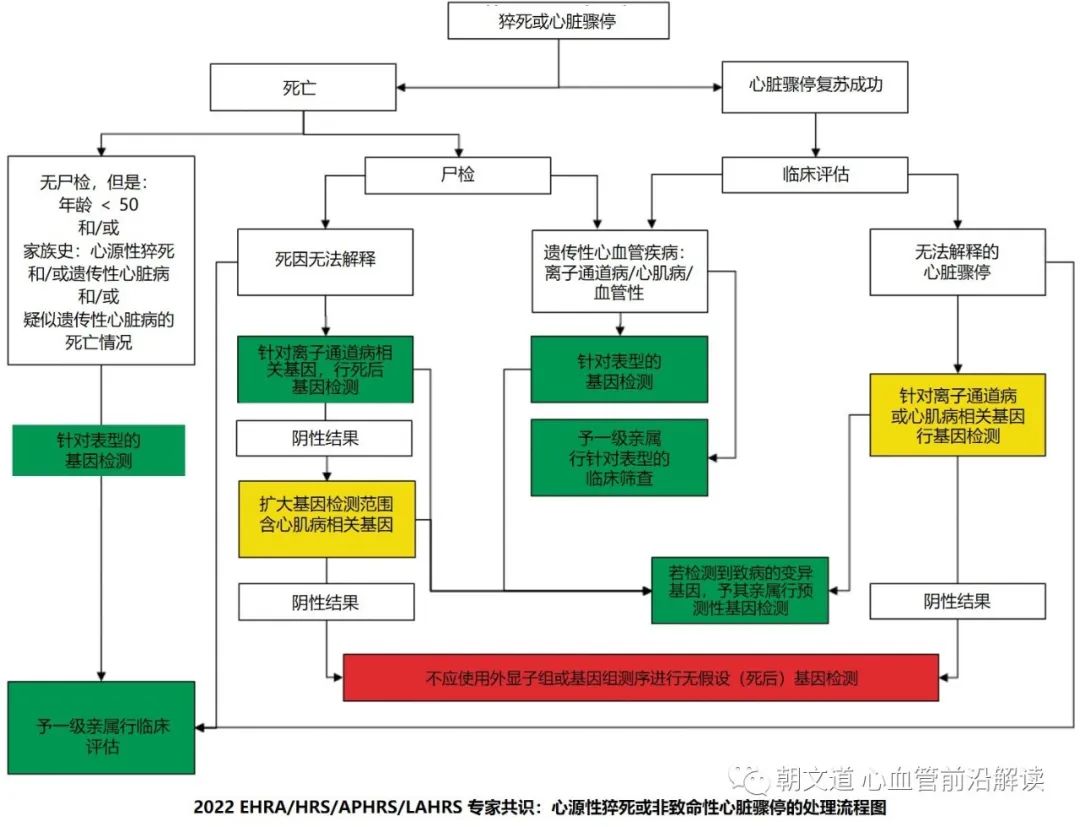
如果遇到的是猝死的患者或者是突发心跳骤停抢救回来的患者,可以采用 2022 年 EHRA/HRS/APHRS/LAHRS 联合发布的专家共识《心脏疾病基因检测的现状》中的流程图。

心肌病和心律失常的基因检测——被忽视的手段
既往国内外大规模流行病学调查显示肥厚型心肌病(HCM)的患病率约为 1/500。随着对心肌病理解的深入以及心脏超声、心脏磁共振等检查水平的提高,学者们发现心肌病的患病率显然是被低估了的。近年来国外的研究报道 HCM 在人群中患病率估计达 1/200,扩张型心肌病(DCM) 为 1/250,致心律失常性心肌病(ACM)为 1/2000。据此估算我国 HCM 患病人数可达 700 万人,DCM 达 560 万,ACM 则为 70 万。这些疾病很多是单基因遗传病,即个体性状受一对等位基因控制,按照孟德尔遗传定律进行传递,遗传模式包括常染色体显性遗传、常染色体隐性遗传及性染色体连锁遗传等。并且部分心肌病有家族遗传聚集特点,因此,明确先证者的诊断并给予家庭成员级联筛查对于猝死的预防就显得尤为重要了。目前,基因诊断是临床和实验室早期识别单基因遗传病的最有效手段,2022 年 EHRA/HRS/APHRS/LAHRS 联合发布了《心脏疾病的基因检测现状专家共识》,指导临床该如何进行基因检测。本期分享的发表于 JAMA Cardiology 上的新研究也关注了心肌病和心律失常的基因检测问题,着重评价了联合两类疾病的基因检测组合对疑似遗传性心肌病或心律失常患者的诊断率和临床管理的意义。