HPV疫苗怎么打?一文看懂接种全流程
11月20日
HPV对宫颈癌的归因危险度百分比可达到100%,因此,通过接种HPV疫苗来预防宫颈癌的发生是非常重要的。世卫组织建议对未开始性生活的女孩进行 HPV 疫苗接种,将获得最佳的预防效果[1]。我国目前已上市5种HPV疫苗,那HPV疫苗应该如何打呢?我们一起来看看~
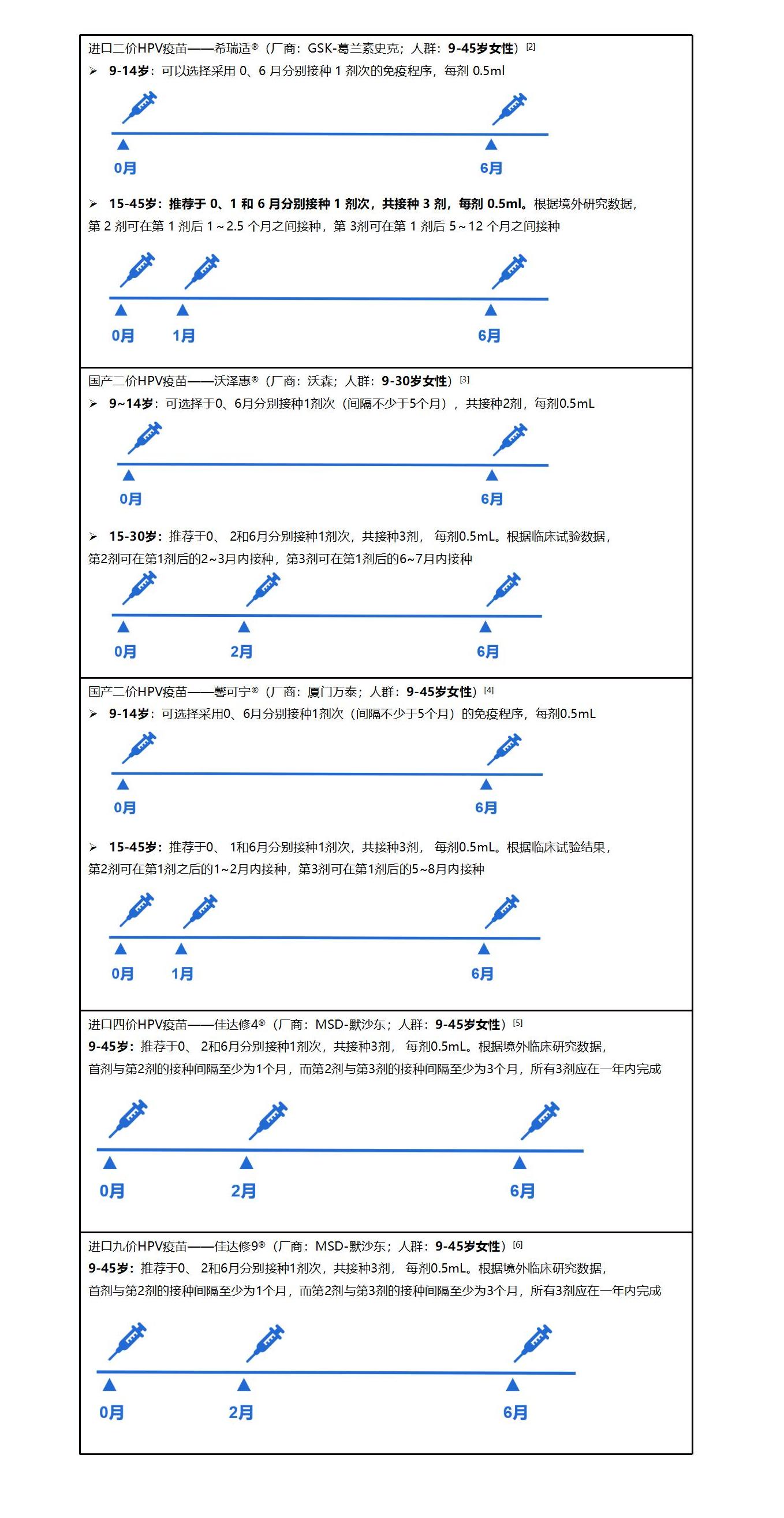
我国上市的5种HPV疫苗接种策略
HPV疫苗接种注意事项[7]:
禁用人群:
对疫苗的活性成分或任何辅料成分有超敏反应者禁止接种HPV疫苗,注射本品后有超敏反应症状者,不应再次接种。
慎用人群:
有血小板减少症或其他可成为肌内注射禁忌证的凝血功能障碍者不宜接种;
妊娠期女性或备孕女性推迟至妊娠期结束后再接种,哺乳期女性接种时应谨慎;
急性疾病常伴有发热等全身症状,接种疫苗可能会加重症状,建议在痊愈后接种;
因部分女性有不同程度的经期不适,建议非经期接种。
在了解接种程序后,相信很多医务人员在HPV疫苗接种过程也会遇到各种各样的问题,我们收集了一些提问高频率的问题,依次来回答~
关于HPV疫苗接种的一些常见问题
Q1:HPV疫苗可以混合接种吗?比如接种第1剂后,第2/3剂可以换成其他品牌?
A1:缺乏依据,不建议。
目前在中国境内获批的5种HPV疫苗说明书中均强调:尚无临床数据支持不同HPV疫苗间互换使用[2-6]。并且,《2022年世界卫生组织HPV疫苗立场文件》提出,不同HPV疫苗具有不同的产品特点、成分和适应证,建议在采用多剂次接种程序时尽量接种同一类型HPV疫苗[8]。综上,建议使用同一种HPV疫苗完成所有的剂次。
Q2:既往感染或正在感染HPV的女性是否还可以接种HPV疫苗?
A2:推荐接种。
因免疫原性过低,HPV自然感染所产生的抗体难以预防相同型别HPV再次感染[7]。因此HPV疫苗对既往HPV再感染(一过性或持续性HPV感染)的女性提供保护效力,同时也可对尚未感染的HPV提供保护,即使感染了1种或多种HPV病毒类型的受种者仍可从疫苗接种中获得保护。
例如,研究数据显示,在除外HPV16/18其他高危型HPV阳性的女性中,进口二价HPV疫苗预防HPV16/18相关12个月持续感染的保护效力为100%[9]。对于正在感染一种疫苗型别的女性,进口二价HPV疫苗预防未感染型别相关 CIN2+的保护效力为90%[10]。
综上,指南推荐无论是否存在HPV感染,对适龄女性均推荐接种HPV疫苗(接种之前无需常规行细胞学及HPV检测)[7]。
真实病例:
某女士(29岁)于体检发现HPV16阳性,其他12型HPV阴性,经阴道镜检查未
发现宫颈病变,于1年后复查HPV转阴。咨询后续管理。
给予宣教:
对于有过性感染的年轻女性,即曾检查HPV阳性后转为阴性的年轻女性,自然感染后不能产生有效的保护性抗体,今后仍有再次感染的风险,建议接种HPV疫苗。某女士选择接种进口二价疫苗后,定期复查,未再出现HPV16感染。
Q3: 高度鳞状上皮内病变(HSIL,属于宫颈癌前病变)患者,经治疗后还可以接种HPV疫苗吗?
A3:推荐接种。
HSIL患者在治疗后可能再次发生HPV感染或感染持续存在。HSIL经局部保守治疗后,CIN2+复发率高达5%~10%,浸润癌风险较普通人群高2~4倍。既往HSIL患者手术治疗后立即接种HPV疫苗,可诱导子宫颈基底层细胞内产生大量抗体,阻止再生组织自身感染,避免HPV进入未感染的基底层细胞,从而避免CIN 2+复发。
因此,指南推荐既往HSIL接受过消融或切除性治疗的适龄女性接种HPV疫苗[7]。
真实病例:
某女士(35岁)体检发现:HPV16以及31+,TCT(HSIL),阴道镜活 检宫颈 3°、12° CIN2 级,6°CIN1级,宫颈管搔刮为粘膜慢性炎,根据《中国子宫颈癌防控指南(2018版)》给予利普刀锥切术治疗,术后病理为CIN2级,切缘净。半年后复查显示:HPV-,TCT-,虽然复查结果正常,但患者依然焦虑紧张,担心再次因HPV感染导致宫颈病变复发,要求预防使用抗HPV药物。
给予宣教:
由于目前缺乏有效预防HPV感染和清除病毒的药物,建议进行HPV疫苗的接种。患者接受建议并接种进口二价HPV疫苗,随访2年至今,复查HPV及TCT均无异常。
Q4:HPV疫苗可以与其他疫苗同时接种吗?
A4:我国目前暂不推荐。
基于国外开展相关临床试验,《2022年世界卫生组织HPV疫苗立场文件》提出,HPV 疫苗可与其他灭活或非灭活疫苗同时接种[8]。但目前在中国境内获批的5种HPV疫苗说明书中均强调:由于境内尚未进行HPV疫苗与其他疫苗联合接种的临床试验[3-6],目前暂不推荐HPV疫苗与其它疫苗同时接种。接种疫苗前三个月内避免使用免疫球蛋白或血液制品。
Q5:免疫功能低下人群可以接种HPV疫苗吗?
A5:视个人情况而定,建议在综合专家医生的评估意见后接种。
免疫功能低下人群,主要包括:HIV感染者、自身免疫性疾病患者、糖尿病患者、肾病患者和器官移植后长期服用免疫抑制剂患者等。
2021年我国指南提出,在疾病稳定的情况下,推荐HIV感染、患有自身免疫性疾病、患有1型/2型糖尿病的适龄女性接种HPV疫苗。肾功能衰竭接受血液透析的适龄女性在病情允许时接种HPV疫苗。对全身脏器功能差、预期寿命有限者不推荐接种。对于器官移植者,若预期寿命长的适龄女性,推荐移植1年后接种HPV疫苗;对于预期寿命有限者,不推荐接种[7]。
另外HPV疫苗说明书同时也强调:免疫力低下人群接种HPV疫苗可能无法诱导充分的免疫应答[2-6]。因此,该人群需平衡风险和获益。
Q6:接种HPV疫苗后还需要进行宫颈癌筛查吗?或定期接受宫颈癌筛查,还需要进行HPV疫苗接种吗?
A6:需要。
接种HPV疫苗属于宫颈癌的一级预防措施,宫颈癌筛查属于二级预防措施。
任何疫苗的保护效果都不是100%,加之少数宫颈癌可能与HPV感染无关,特别是HPV阴性的特殊类型癌。所以,接种HPV疫苗不能取代常规宫颈癌筛查。而宫颈癌筛查可早期发现宫颈病变情况,从而降低疾病负担。
因此,需要“接种HPV疫苗”+“定期宫颈癌筛查”以达到最好的预防效果。
真实病例:
某女士(27岁)已婚,有规律性生活史,自我保健意识很强,定期进行宫颈HPV和TCT的检查。进口二价HPV疫苗上市以后,前来咨询定期宫颈癌筛查无异常,有无接种HPV疫苗的必要。
给予宣教:
宫颈癌的防治三级体系中,宫颈癌筛查是二级预防,而接种HPV疫苗属于一级预防,大于25岁的女性预防宫颈癌的最佳策略,是在接种HPV疫苗的基础上,做好定期宫颈筛查,两者相结合,能够达到最佳预防效果。该女士听从建议,在接种进口二
价HPV疫苗的基础上,每年定期进行宫颈癌筛查体检,无异常。
PM-CN-CER-NLTR-230047,有效期至2025年8月
本资料并非广告。本资料基于科学信息制作且仅供医疗保健专业人士阅读。请勿传播本资料。
参考文献:
[1] 中华预防医学会. 预防接种知情告知专家共识(下) [J] . 中华预防医学杂志, 2021, 55(3) : 289-323.
[2] 二价HPV疫苗(进口)-希瑞适新版说明书-GSK
[3] 二价HPV(国产)沃泽惠说明书-沃森
[4] 二价HPV疫苗(国产)馨可宁说明书-厦门万泰
[5] 四价HPV疫苗(进口)-佳达修4说明书-默沙东
[6] 九价HPV疫苗(进口)-佳达修9说明书-默沙东
[7] 中华医学会妇科肿瘤学分会. 人乳头瘤病毒疫苗临床应用中国专家共识[J]. 中国医学前沿杂志(电子版);2021;13(2):1-12.
[8] 赵雪莲,等.2022年世界卫生组织HPV疫苗立场文件的解读[J].中国预防医学杂志,2023,24(03):161-167.
[9] Hu SY,et al.Efficacy of the AS04-adjuvanted HPV-16/18 vaccine in young Chinese women with oncogenic HPV infection at baseline: post-hoc analysis of a randomized controlled trial.Hum Vaccin Immunother. 2021 Apr 3;17(4):955-964. PMID: 33180670
[10] Szarewski A, et al. Efficacy of the human papillomavirus (HPV)‐ 16/18 AS04‐adjuvanted vaccine in women aged 15‒25 years with and without serological evidence of previous exposure to HPV‐16/18. International Journal of Cancer, 2012, 131(1): 106-116.
希瑞适®简明处方资料
【药品名称】
通用名:双价人乳头瘤病毒吸附疫苗
商品名:希瑞适(CERVARIX)
【成份和性状】
活性成份:
1剂量( 0.5ml)含:
人乳头瘤病毒 16型 L1蛋白 * 20μg
人乳头瘤病毒 18型 L1蛋白 * 20μg
* L1蛋白,以非感染性的病毒样颗粒(VLPs)形式存在,通过 DNA重组技术用杆状病毒表达系统在源于粉纹夜蛾的 Hi-5 Rix4446细胞中表达而获得。
佐剂:
AS04佐剂系统 ,1剂量( 0.5ml)含 :
3-O-去酰基 -4’-单磷酰脂 A(MPL) 50μg
氢氧化铝 水合物 Al 3+ 总量 0.5mg
其它 辅料:
氯化钠、二水合磷酸氢钠、注射用水
性状:
0.5ml注射用悬液,装于玻璃预充注射器中。
本品静置时为无色上清液和白色沉淀 ,摇匀后呈混浊液 。
【接种对象】
本品适用于9~45岁的女性。
【作用与用途】
本品适用于预防因高危型人乳头瘤病毒(HPV)16、18型所致下列疾病:
•宫颈癌
•2级、3级宫颈上皮内瘤样病变(CIN2/3)和原位腺癌(AIS)
•1级宫颈上皮内瘤样病变(CIN1)
【规格】
0.5ml/支(含HPV-16 L1蛋白和HPV-18 L1蛋白各20μg)。
【免疫程序和剂量】
(1)本品肌肉注射,首选接种部位为上臂三角肌。
(2)本品推荐于0、1和6月分别接种1剂次,共接种3剂,每剂0.5ml。
根据本品境外研究数据,第2剂可在第1剂后1~2.5个月之间接种,第3剂可在第1剂后5~12个月之间接种。
(3) 根据本品临床试验结果并参考2017年WHO《HPV疫苗立场文件》推荐,对于9~14岁女性也可以选择采用0、6月分别接种1剂次的免疫程序,每剂0.5ml。
尚未确定本品是否需要加强免疫。
【不良反应】
全身不良反应
十分常见:疲乏、头痛、肌痛、发热(境内数据,≥37 °C) 。常见:发热(境内数据,≥38 °C)、胃肠道症状(包括恶心、呕吐、腹泻和腹痛)、关节痛、瘙痒、皮疹和荨麻疹。偶见:上呼吸道感染、头晕。
局部不良反应
十分常见:注射部位疼痛、发红和肿胀。 偶见(境外临床试验):注射部位的其他反应,如硬结、局部感觉异常。
以上大部分不良反应程度为轻至中度,且短期内可自行缓解。
详细不良反应请参见希瑞适产品说明书。
境外上市后监测
除了上述临床试验中报告的不良反应以外,自本品上市后(2007年),从全球收集了以下不良事件报告(包括严重不良事件和可能与本品接种相关的事件)。由于这些事件来自自发报告的无法确定总数的人群,因此,无法准确地估计其发生频率或确定其与本品接种之间的因果关系。
免疫系统异常:
过敏反应(包括速发过敏反应和类速发过敏反应),血管性水肿,血小板减少性紫癜。
神经系统异常:
接种导致的晕厥或血管迷走神经反应(有时还伴有强直-阵挛性发作)。
急性播散性脑脊髓炎(ADEM):接种后数天至2周左右,有可能会出现发热、头痛、惊厥、运动障碍性疾病或意识障碍。具体频率不详。
格林巴利综合征:表现为诸如从肢体远端开始的弛缓性麻痹这类症状、腱反射下降或消失。具体频率不详。
血液及淋巴系统异常:淋巴结病
全身性异常:寒战
有报道在接种本品后,某些受种者可能会出现不局限于注射部位的剧痛(如肌肉痛、关节痛和皮肤痛)、麻木、无力感等并且持续较长时间,但发生机制尚未明确。因此,如果出现此类异常,应采取适当的措施,如前往能够进行神经学和免疫学鉴别诊断并提供专业诊疗的医疗机构就诊。
【禁忌】
对本品中任一活性成分或辅料严重过敏者。
【注意事项】
1. 接种本品前医疗人员应询问和审阅受种者的病史(尤其是既往接种史和是否发生过与疫苗接种有关的不良反应)并进行临床检查,评估接种本品的获益与风险。本品不推荐用于该说明书【接种对象】以外人群。
2. 与其他注射用疫苗一样,需准备适当的医疗应急处理措施和监测手段,以保证在接种本品后发生过敏反应者能够及时得到处置。
3. 晕厥反应:接种疫苗后可能会出现晕厥,导致跌倒并受伤,因此,建议接种后留观至少15分钟或按接种要求留观。
4. 乳胶反应:本品预充式注射器的针帽可能含有天然胶乳,会引起乳胶敏感人群的过敏反应。
5. 与其他疫苗一样,在受种者患有急性严重发热疾病时应推迟接种本品。如果仅为感冒等轻微感染,则无需推迟接种。
6. 本品严禁静脉或皮内注射。尚无本品皮下接种的临床数据。受种者为血小板减少症患者或者任何凝血功能紊乱患者时应谨慎使用本品。
7. 与其他疫苗一样,接种本品可能无法对所有受种者产生100%的保护作用。
8. 本品仅用于预防用途。
9. 本品不能预防所有高危型HPV感染所致病变。
10. 疫苗接种不能取代常规宫颈癌筛查,也不能取代预防HPV感染和性传播疾病的其他措施。
11. 受限于相关临床数据的佐证,当无症状的HIV感染者或免疫功能低下者接种本品时,可能无法产生足够的免疫应答。
12. 目前尚未无安全确定本品的保护时长。
详细注意事项请参见希瑞适产品说明书
【妊娠和哺乳期妇女用药】
在妊娠妇女中收集到的有限数据尚不足以判断接种本品后是否导致发生不良妊娠的风险。妊娠期间应避免接种本品。若女性已经或准备妊娠,建议推迟或中断接种程序,妊娠期结束后再进行接种。
在临床试验中,尚未观察本品诱导的抗体经母乳分泌情况。由于许多药物可经母乳分泌,因此,哺乳期妇女接种本品时应谨慎。
【药物相互作用】
由于境内尚未进行本品与其他疫苗联合接种的临床试验,目前暂不推荐本品与其它疫苗同时接种。接种本品前三个月内避免使用免疫球蛋白或血液制品。
由于缺乏配伍禁忌研究,因此本品禁止与其他医药产品混合注射。
【贮藏】
冷藏储存于2°C~8°C,避光保存于原包装盒内。不得冻结,如发生冻结应予以废弃。贮藏期间,可能会观察到疫苗中存在白色细小沉淀和无色澄清上清液,这并不代表疫苗变质。
【有效期】 48个月。
【执行标准】 进口药品注册标准:JS20120047。
【批准文号】 药品批准文号:国药准字SJ20160025。
【生产企业】
企业名称:GlaxoSmithKline Biologicals S.A.
生产地址:Parc de la Noire Epine, Rue Fleming 20, Wavre 1300, Belgium
驻中国办事处:上海市西藏中路168号都市总部大楼6楼; 邮编:200001
电 话:86 21-23019800
传 真:86 21-23019801
GSK服务热线:800-820-3383/400-183-3383
商标为葛兰素史克集团拥有或授权使用。
©[2018]葛兰素史克集团或其授权人。
详细处方资料备索。处方前请参阅详细处方资料。
本资料并非广告。本资料旨在向且仅向医疗保健专业人士提供科学信息。如果您不是医疗保健专业人士,请勿阅读或传播其中的内容。PI-10084。
为了帮助我们监测GSK药品的安全性,如果您发现在使用GSK药品过程中发生任何不良事件或可能的用药过量,请拨打葛兰素史克服务热线 800-820-3383/ 400-183-3383

















