传说中的病从口入!科学家证明口腔微生物可杀进肠道,诱发肠道疾病
10月23日
10月19日的《科学》上,日本庆应义塾大学和早稻田大学的研究人员发表了最新的研究成果,证实了口腔细菌与肠道疾病之间的关系,为治疗炎症性肠病提供了新的角度!
“病从口入”这句话,足有一千多年的历史了。在传统观念里,对这四个字的理解更多是与进食食物不洁导致的疾病。不过今天我们要说的可不是这个,而是告诉各位:口腔的常住居民——口腔微生物,遛弯儿到肠道之后也会对肠道健康产生不良的影响。也许你还不知道,有些寄居口腔的良民,换个地儿之后居然露出来凶神恶煞的一面。

卡通版的口腔微生物看上去人畜无害,可惜事实并非如此
已有许多研究证据显示,艾滋病、肝硬化、炎症性肠病(IBD)等许多疾病当中,患者肠道微生物发生的改变都能追溯到口腔来源的微生物[1-3],但能否直接把引发疾病的大锅甩给口腔微生物去背呢?
至少在炎症性肠病上,这个锅可能还真得口腔微生物来背。
10月19日的《科学》上,日本庆应义塾大学和早稻田大学的研究人员发表了最新的研究成果,研究人员发现,炎症性肠病患者唾液中的肺炎克雷伯氏菌会迅速定植到小鼠肠道,导致强烈的炎症反应,直接证实了口腔细菌与肠道疾病之间的关系,为治疗炎症性肠病提供了新的角度[4]!
炎症性肠病主要包括克罗恩病和溃疡性结肠炎两种,在欧美国家的患病率可达300-500/10万人[5],我国发病率近年来也显著上升,已成为消化系统的常见病[6]。炎症性肠病发病机制复杂,涉及环境、遗传、微生物、免疫等多种因素,一直是科研关注的热点。
虽然患病率居高不下,但遗憾的是目前仍然没有根治炎症性肠病的办法。目前临床常使用糖皮质激素、免疫抑制剂等药物对患者进行治疗,但也只能以延缓病情进展和控制急性发作为目标,因此有些被折磨得无法忍受的患者,竟然选择了粪便移植的疗法……对,可以理解为吃屎来改变肠道微生物的组成[7]……
科研界一直在对肠道微生物在炎症性肠病中的作用进行探索,早在2014年科学家们就发现,在未经治疗的克罗恩病患者肠道微生物中,多种微生物的存在和数目变化与疾病的进展密切相关,可其中却有着韦荣氏球菌(Veillonellaceae)和梭杆菌(Fusobacteriaceae)两种本是在口腔安家落户的微生物,显然,它们也不是去做友好访问的。
口腔微生物进入肠道并不奇怪,毕竟人每天要吞咽下大量的唾液(约1.5升),足够让大把的口腔微生物搭便车了,但它们一般很难存活在肠道,更不会反客为主当上地头蛇,只有当原有的肠道菌群因抗生素等外界原因出现紊乱时,鸠占鹊巢的一幕才会上演[8]。

听说,接吻一次就足够让唾液里8000万个微生物被交换……
由于临床常使用抗生素处理炎症性肠病的并发症,结合对患者和正常人的肠道微生物进行分析,日本科学家们认为,抗生素的干预给长驱直入等待致病的口腔细菌创造了条件,从而导致肠道出现炎症。
真的是这样一回事吗?
研究人员把两名克罗恩病患者的唾液样本用鼻饲法移植到了经无菌处理的小鼠中,发现移入第二例患者唾液样本的小鼠肠内I型辅助性T细胞(Th1)的表达水平立刻显著升高,意味着肠内出现了明显的炎症反应,而这就是炎症性肠病最典型的表现。
利用16S rRNA测序法,研究人员对比了小鼠粪便微生物和患者唾液样本肠道微生物的组成,发现粪便中的主要微生物种类与唾液样本中的一小撮致病微生物种类几乎完全相符,因此研究人员断定,的确有一批口腔来源的“破坏分子”杀进了肠道,诱导由Th1细胞导致的炎症反应。
在对小鼠粪便中的主要微生物进行分离培养和接种试验后,研究人员把嫌疑人对象锁定在了数量最多的肺炎克雷伯氏菌(致病菌株为KP-2H7)上。由于对多种抗生素存在耐药性,一旦感染就相当难以对付,肺炎克雷伯氏菌所属的克雷伯氏菌属是医院内感染的常见病原体。虽说一般不会导致口腔炎症,但这种强悍的细菌的确很可能“一站到底”,经受住从口腔到肠道过程中的免疫应答,随后引发炎症。
进一步的试验显示,KP-2H7并不会定植在未经抗生素治疗小鼠的肠道,它需要在肠道微生物原有的平衡被扰乱后才能趁虚而入,如果宿主是缺少与某些炎性介质有关基因的结肠炎易感个体,KP-2H7就会导致由Th1细胞介导的炎症。同时,KP-2H7还会激活肠内树突状细胞上的Toll样受体TLR4,使树突状细胞调控内皮细胞释放炎性介质白介素-18(IL-18),进一步增强炎症反应,来个火上浇油。
不过想要构成完整的证据链条,“现场证据”还是必不可少的。研究人员对此前资料进行再次分析后发现,在炎症性肠病、原发性硬化性胆管炎和饮酒者群体中,克雷伯氏菌属细菌的比例确实显著升高,麻省总医院和宾夕法尼亚大学的炎症性肠病患者队列数据也进一步证实了克雷伯菌氏属细菌与肠道炎症的关系。凶手就这么被抓了出来。
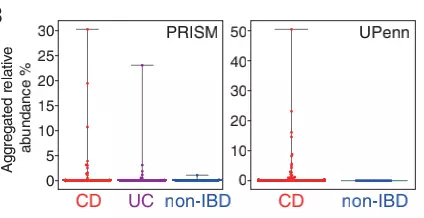
炎症性肠病患者体内克雷伯菌的比例(红/紫)较正常人(蓝)显著升高
日本科学家们本次的研究,证实了口腔的确是导致肠道炎症细菌的聚集地。
即使克雷伯氏菌属细菌不最先进入肠道搞破坏,其他原因导致的炎症也会扰乱肠道微生物原有的平衡,给口腔细菌们创造机会,因此研究人员表示:“针对口腔细菌进行治疗不止可以对付炎症性肠病,还有望成为其他与炎症相关慢性疾病的新策略”。
在同期刊登的社论中,中国医学科学院院长、北京协和医学院校长曹雪涛院士认为:“虽然患者群体的数据尚属相关性,但这一实验的发现有力阐述了口腔中克雷伯菌在炎症性疾病中的作用。论文提出了针对口腔细菌来预防或治疗慢性炎症性疾病的初步构想,可以从防止致病型克雷伯菌感染或Th1细胞导致的致病炎症过程入手,但也需要进一步阐明致病微生物、宿主肠道菌群和T细胞介导的免疫反应在炎症过程中的具体相互作用。”[9]研究人员也表示,下一步将着力于开发清除致病型克雷伯菌或防止其定植进入肠道的抗生素类药物[10]。
看来口腔细菌还真是人体不怀好意的房客,随时伺机而动引发疾病。虽说奇点糕经常被老妈唠叨“刷牙的力气像刷鞋”,不过把牙尽量刷好,从而尽可能让细菌无处藏身,应该还是很有用的。
参考资料:
1.Lozupone C A, Li M, Campbell T B, et al. Alterations in the gut microbiota associated with HIV-1 infection[J]. Cell host & microbe, 2013, 14(3): 329-339.
2.Gevers D, Kugathasan S, Denson L A, et al. The treatment-naive microbiome in new-onset Crohn’s disease[J]. Cell host & microbe, 2014, 15(3): 382-392.
3.Qin N, Yang F, Li A, et al. Alterations of the human gut microbiome in liver cirrhosis[J]. Nature, 2014, 513(7516): 59.
4.http://science.sciencemag.org/content/358/6361/359
5.http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32448-0/fulltext
6.中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年·广州)[J]. 中华内科杂志, 2012, 51(10):763-781.
7.https://www.theverge.com/2016/5/4/11581994/fmt-fecal-matter-transplant-josiah-zayner-microbiome-ibs-c-diff
8.Seedorf H, Griffin N W, Ridaura V K, et al. Bacteria from diverse habitats colonize and compete in the mouse gut[J]. Cell, 2014, 159(2): 253-266.
9.http://science.sciencemag.org/content/358/6361/308
10.https://www.waseda.jp/top/news/54628
图片来源:123rf


















