PACTRIMS 2019:抗IL-6受体抗体即将成为NMOSD治疗新焦点
12月19日
第12届亚太多发性硬化治疗和研究委员会年会(PACTRIMS 2019)于2019.11.13-15在新加坡举行。
第12届亚太多发性硬化治疗和研究委员会年会(PACTRIMS 2019)于2019.11.13-15在新加坡举行,天津医科大学总医院施福东教授及日本国立神经科学研究所Takashi Yamamura教授等众多专家对视神经脊髓炎谱系疾病(NMOSD)的发病机制及治疗新方案进行了阐述。
清除B细胞or调节B细胞功能
B细胞消耗疗法被尝试用于治疗NMOSD,如靶向CD20、CD19治疗。
然而,研究表明,浆母细胞即CD19intCD20−CD27+CD38+ B细胞亚群是产生水通道蛋白4抗体(AQP4-IgG)的主要来源,由于这群细胞是CD20−,因此不会受到靶向CD20抗体的影响,这也是有些患者尽管接受靶向CD20治疗仍有复发的原因[1]。
与CD20靶向治疗相比,CD19靶向治疗扩大了细胞耗竭的窗口[2]。不过,文献报道,CD19靶向治疗存在一些潜在问题,例如使保护性体液免疫和宿主对病原体和肿瘤的防御减弱,使疫苗的获得性适应性免疫减弱等[3]。此外,CD19靶向治疗在一定条件下也降低了B细胞激活的阈值,这可以增强B细胞的激活,甚至加剧自身免疫[2]。
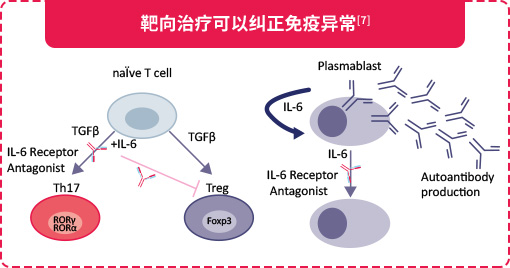
不仅如此,B细胞消耗治疗也会影响具有免疫抑制潜力的B细胞,这也解释了B细胞消耗治疗期间报道的一些罕见自身免疫性病例[2]。因此,在NMOSD治疗中应更关注调节B细胞的功能(比如IL-6受体通路),而不是单纯清除B细胞。
研究者发现,在实验性自身免疫性脑脊髓炎(EAE)小鼠模型中,B细胞消耗疗法仅改善具有野生型B细胞的小鼠的病情,对具有IL-6缺陷B细胞的小鼠无显著疗效,证实了IL-6在EAE的发病中起到重要作用[4]。而且,研究表明,浆母细胞的存活依赖于IL-6,阻断IL-6信号转导可降低浆母细胞的存活、减少AQP4-IgG的产生[1]。
何为IL-6?与NMOSD有何关联?
IL-6是一种典型的维持内环境稳定的细胞因子,可由活化T细胞和B细胞、单核/巨噬细胞、内皮细胞、成纤维细胞、间叶细胞等多种细胞分泌产生[4-7]。当体内内环境稳态被感染或组织损伤破坏时,IL-6立即产生,并通过激活急性期反应和免疫反应起到宿主防御作用。然而,IL-6过度持续合成对急性全身炎症反应综合征和慢性免疫介导疾病都会产生病理影响[5]。
近期研究表明,NMOSD患者的血清和脑脊液中IL-6水平升高,尤其是在复发期间,并且与病情的活动性和AQP4-IgG滴度相关,提示IL-6在NMOSD的发病机制中具有一定作用,可作为NMOSD的治疗靶点[8-11]。
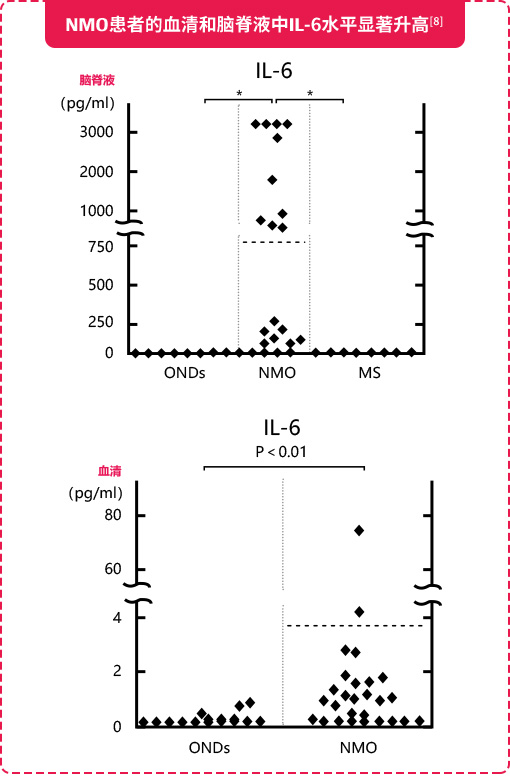
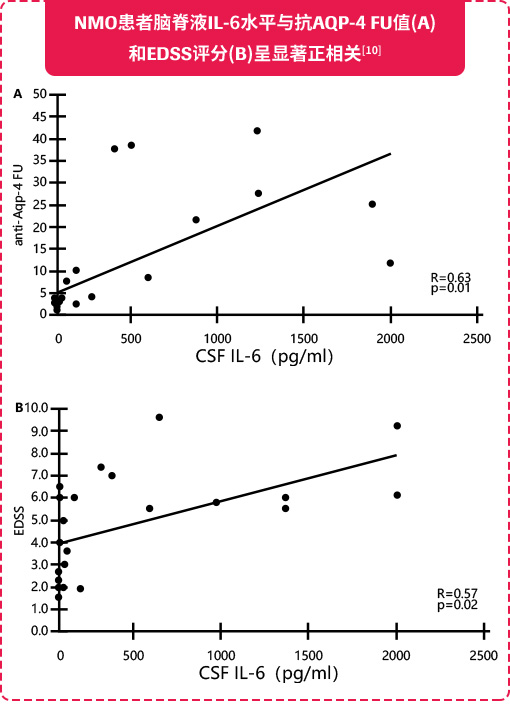
IL-6具有重要生物学活性,参与多种免疫活动
IL-6对炎症、免疫反应和造血具有多效性影响,参与B细胞自身抗体的产生、T细胞的活化、巨核细胞的成熟、肝细胞急性期蛋白的产生(如CRP)等[5]。IL-6表达异常是多种自身免疫性炎症性疾病发生发展的原因之一[7]。
1. IL-6上调Th17/Treg平衡
在获得性免疫反应中,IL-6可以调节naïve CD4+ T细胞分化方向,抑制由转化生长因子β(TGF-β)诱导的向调节性T细胞(Treg)的分化,促进向辅助性T细胞17(Th17)的活化,导致Th17/Treg比例上调,平衡破坏,进而促进各种自身免疫性和慢性炎症性疾病的发展[4,5]。此外,IL-6还可以促进滤泡辅助性T细胞(TFH)分化以及IL-21的产生,调节免疫球蛋白(Ig)的合成[4,5]。
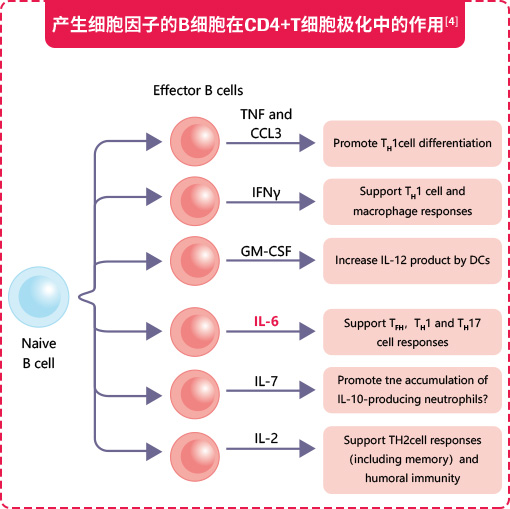
2. 促进B细胞靶向分化及浆母细胞分泌AQP4
证据表明,IL-6分泌是自身免疫性疾病中B细胞驱动发病机制的主要机制[12]。IL-6最初被鉴定为B细胞刺激因子2(BSF-2),可促进活化的B细胞分化为产生Ig的浆细胞[7]。2015年,Li等描述了一种新的人类B细胞亚群,其特征是表达粒细胞巨噬细胞集落刺激因子和大量产生促炎细胞因子IL-6和肿瘤坏死因子[13,14]。IL-6能促进浆母细胞的存活,浆母细胞可产生自身抗体,例如视神经脊髓炎(NMO)患者的AQP4[7,15]。
3. IL-6增加血脑屏障的通透性
IL-6信号转导可能通过与血脑屏障上其他类型细胞相互作用而影响粘附分子的表达,从而在中枢神经系统自身免疫性炎症中发挥作用[16]。既往研究也表明,IL-6不仅可以在体外诱导BBB的破坏[17],也可以在体内影响BBB的发育和生理功能[18]。
4.IL-6促进CNS内炎症反应及脱髓鞘变化
此外,2000年,Brunello等发现,在BBB即使没有严重破坏的情况下,IL-6/sIL-6R(可溶性IL-6受体)仍然可以透过血脑屏障导致星形胶质细胞足突肿胀,产生中枢神经系统(CNS)内炎症反应及脱髓鞘变化[19]。证据还表明,IL-6基因敲除小鼠(IL-6−/−小鼠)对髓鞘少突胶质细胞糖蛋白诱导的EAE具有抵抗力[16]。
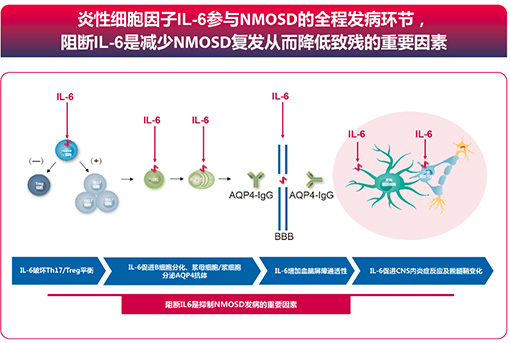
由此可见,IL-6参与了NMOSD的全程发病环节,而阻止IL-6信号通路的转导,对于NMOSD的预防具有一定临床实践意义[4-19]。
抗IL-6受体抗体即将成为NMOSD治疗新焦点,satralizumab值得期待
据悉,目前在研的抗IL-6受体抗体有satralizumab(SA237)[20]。在PACTRIMS 2019会议期间,satralizumab(SA237)也公布了其关键性研究SakuraSky的数据。
Satralizumab(SA237)是一种运用SMART™再循环技术的人源化IgG2单抗,靶点为IL-6受体(IL-6R),可最大化抑制IL-6信号转导,同时最小化安全性风险[20]。2018年,FDA授予satralizumab治疗NMO/NMOSD的突破性药物资格(BTD)[21]。另外,在美国和欧盟,satralizumab均被授予治疗NMOSD的孤儿药资格[22]。
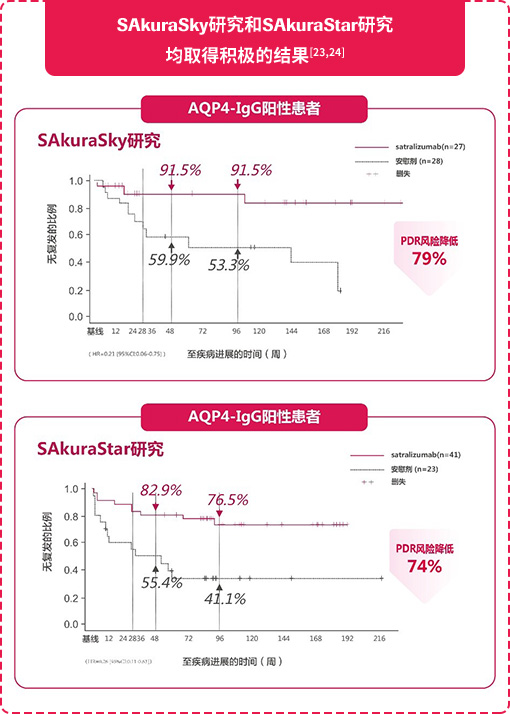
SAkuraSky研究[23]结果旨在评估satralizumab联合基线疗法治疗NMOSD的疗效和安全性。数据显示,在AQP4抗体阳性亚组患者(n=55)中,第48周和第96周,satralizumab治疗组的无复发患者比例均为91.5%。此外,之前发布的另一项全球RCT研究SAkuraStar研究[24](satralizumab单药治疗)也取得了积极的结果:与安慰剂相比,satralizumab可使AQP4抗体阳性患者的首次协议定义的复发(PDR)风险显著降低74%(HR=0.26[95%CI:0.11-0.63 ])。
而且,satralizumab在联合或单药治疗的研究中均表现出良好的安全性,严重不良事件(包括严重感染)的患者比例与基线治疗/安慰剂相似,均无严重过敏反应及死亡发生。该研究时间持续96周,较一般研究的28周或48具有更明确的长期安全性及疗效,可长期使用。
Satralizumab的临床疗效和安全性也进一步印证了IL-6在NMOSD发病机制中的作用,以及抗IL-6抗体治疗NMOSD,预防复发的可行性。据悉,satralizumab已启动全球的上市申请,中国的申请工作亦在准备中。对于尚无获批治疗药物可用的广大NMOSD患者而言,这无疑是一个好消息。
本文由第三方提供,内容不代表本平台立场,仅供参考。
参考文献:
[1] Pittock SJ, Lucchinetti CF. Ann N Y Acad Sci. 2016 Feb;1366(1):20-39.
[2] Mei HE, et al. Arthritis Res Ther. 2012;14 Suppl 5:S1.
[3] Forsthuber TG, et al. Ther Adv Neurol Disord. 2018 Mar 21;11:1756286418761697.
[4] Shen P, Nat Rev Immunol. 2015 Jul;15(7):441-51.
[5] Tanaka T, et al. Cold Spring Harb Perspect Biol. 2018 Aug 1;10(8). pii: a028456.
[6] Kishimoto T. Annu Rev Immunol. 2005;23:1-21.
[7] K. Nakao et al. (eds.), Innovative Medicine, DOI 10.1007/978-4-431-55651-0_11.
[8] Uzawa A, et al. Mult Scler. 2010 Dec;16(12):1443-52.
[9] Ringelstein M, et al. JAMA Neurol. 2015 Jul;72(7):756-63.
[10] Içöz S, et al. Int J Neurosci. 2010 Jan;120(1):71-5.
[11] Kong BS, et al. J Neuroinflammation. 2017 Sep 25;14(1):191.
[12] Barr TA, et al. J Exp Med. 2012 May 7;209(5):1001-10.
[13] Bar-Or A. Lancet Neurol. 2016 Jan;15(1):9-11.
[14] Li R, et al. Sci Transl Med. 2015 Oct 21;7(310):310ra166.
[15] Chihara N, et al. Proc Natl Acad Sci U S A. 2011 Mar 1;108(9):3701-6.
[16] Linker RA, et al. J Neuroimmunol. 2008 Dec 15;205(1-2):64-72.
[17] de Vries HE, et al. J Neuroimmunol. 1996 Jan;64(1):37-43.
[18] Brett FM, J Neuropathol Exp Neurol. 1995 Nov;54(6):766-75.
[19] Brunello AG, et al. Am J Pathol. 2000 Nov;157(5):1485-93.
[20] Kaplon H, Reichert JM. MAbs. 2019 FebMar;11(2)219-238.
[21] Chugai’s Satralizumab Receives FDA Breakthrough Therapy Designation for Neuromyelitis Optica and Neuromyelitis Optica Spectrum Disorders.
[22] Chugai Receives Orphan Drug Designation for Satralizumab in Neuromyelitis Optica and Neuromyelitis Optica Spectrum Disorder from the Ministry of Health, Labour and Welfare.
[23] Chugai Presents Results from Phase III Study of Satralizumab in NMOSD at ECTRIMS 2018 (October 15, 2018).
[24] Chugai Presents Results from Second Positive Global Phase III Clinical Study of Satralizumab in NMOSD at ECTRIMS 2019 (Sep 12, 2019).

















